最新!一致性评价进度汇总
2019-05-25
▍来源:华招医药网
据统计,截止至2019年5月21日,CDE已承办了 1121个一致性评价受理号,涉及340个品种,352家企业,其中201个受理号已通过一致性评价,通过率约为18%。
除此之外,还有76个按新化药4类等类别批准,视同通过一致性评价的药品。
表1:仿制药一致性评价总体进展一览表
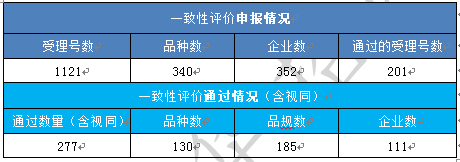
注:统计截止日期为2019年5月21日,因部分药品通过(含视同)后,尚未及时纳入《中国上市药品目录集》,故此处统计的通过数量(含视同)比目录集中的多。
一、仿制药一致性评价申报情况分析
1.1 按受理时间:2019年1月达到顶峰,之后回落并趋于平稳
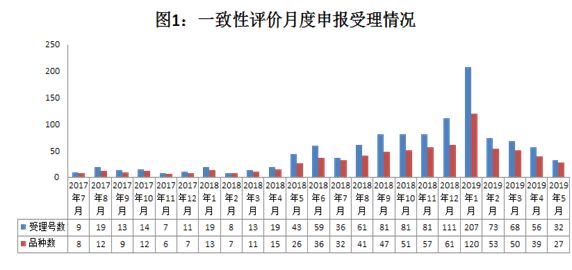
注:统计截止日期为2019年5月21日
从CDE每月承办的仿制药一致性评价受理号数量来看,开展初期,即2017年7月-2018年4月,每月申报数量较少;从2018年5月—2019年1月,申报数量逐渐递增,尤其在2019年1月,数量剧增,这或许与之前的“289目录2018年底前通过评价”的时限有关,而2018年12月申报的品种,或许大多拖到了2019年1月开始受理,因此申报数量呈明显上升之势。
值得注意的是,2018年12月28日,国家药监局发布了《关于仿制药质量和疗效一致性评价有关事项的公告(2018年第102号)》,明确提及对纳入国家基本药物目录的品种,不再统一设置评价时限要求,即“289目录”通过时限取消。但同时也表示,化学药品新注册分类实施前批准上市的含基本药物品种在内的仿制药,自首家品种通过一致性评价后,其他药品生产企业的相同品种原则上应在3年内完成一致性评价。逾期未完成的,企业经评估认为属于临床必需、市场短缺品种的,可提出延期评价申请予以适当延期。逾期再未完成的,不予再注册。
也许是因为“289目录”时限取消,自2019年2月以来至今,受理号数量回落并趋于平稳。而根据《中国上市药品目录集》查询,目前通过一致性评价的药品最早的批准时间为2017年7月,根据“自首家通过后,其余企业3年内完成”的规定,意味着部分药品到2020年7月还未通过,可能将不予再注册(除临床必需、市场短缺品种),相关企业需抓紧时间布局。
1.3按药品成分:阿莫西林、二甲双胍、氨氯地平位列申报数量前三甲
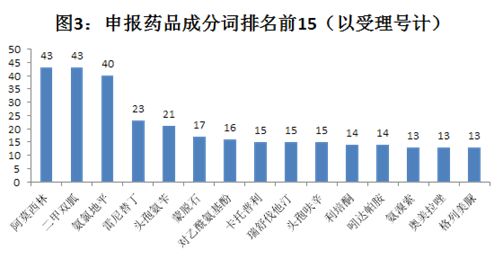
注:统计截止日期为2019年5月21日
从申报药品的主成分来看,二甲双胍、阿莫西林、氨氯地平排名前三,均是市场空间和用量较大治疗领域的品种。这几个主成分中,剂型以普通片剂居多,此外,还有胶囊剂、缓释片剂、颗粒剂、干混悬剂等其他剂型。
由于这三种成分涉及的批文很多,需开展一致性评价的企业也很多,就目前来看,这三种成分涉及的企业提交一致性评价申请数量还远低于需开展评价企业数量,其中,最低的不足20%。
1.5按申报剂型:片剂为主流剂型,注射剂一致性评价已提上日程
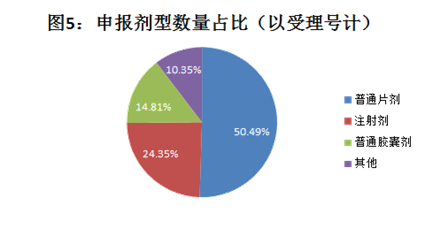
注:统计截止日期为2019年5月21日
目前CDE承办的1121个一致性评价受理号中,普通片剂约占一半,位居第一,注射剂排名第二,占比约为24.35%,普通胶囊剂占比约为14.81%,位居第三,其余剂型(包括散剂、肠溶胶囊、缓释片等)占比约10.35%。
目前我国开展的主要是口服固体制剂一致性评价工作,而片剂和胶囊剂是口服固体制剂中的两个主要种类,是仿制药一致性评价工作的“主力军”。而近年来,注射剂市场保持持续增长态势的同时,不良反应占比居高不下,所以注射剂一致性评价呼声不断。
国家层面也曾表示,适时启动注射剂再评价,力争5至10年基本完成。从目前申报情况来看,部分企业已着手布局,先行发力!
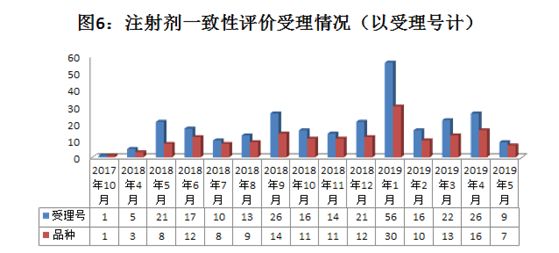
注:统计截止日期为2019年5月21日
据统计,目前CDE已承办了273个注射剂一致性评价受理号,每月受理情况如图6所示。可以发现,2017年10月,CDE承办了第一个注射剂一致性评价受理号,为海南普利的注射用阿奇霉素。而从2018年4月开始,注射剂一致性评价逐渐步入正轨,每月均受理了不同数量的注射剂。
同整体趋势大体一致,注射剂也是2019年1月达到顶峰,2019年2月开始,又开始回落,2-4月受理数量持续增长。从治疗领域来看,目前受理的注射剂药品,主要是抗肿瘤注射剂、抗菌药注射剂和神经系统注射剂三类,约占了60%。
值得注意的是,2019年3月底,CDE公示了第二十一批参比制剂,有200余个是注射剂,涉及80余个品种(以药品通用名统计),而此前公布的参比制剂目录中,注射剂的数量为零,业内普遍认为,此份参比制剂的公布将促使注射剂一致性评价加速!
二、仿制药一致性评价通过情况分析
2.1按通过时间:2018年12月达到峰值,2019年趋于平稳
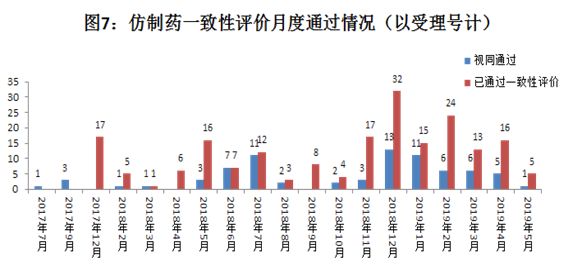
注:统计截止日期为2019年5月21日
如图7所示,2017年通过数量很少,2018年数量有所提升,但每月分布不均,其中2018年12月达到最高点。而2019年开始,每月通过(含视同)的数量,相对稳定,1月至4月基本保持在20-30个左右。而总体来看,视同通过的药品,约占总数的27.4%,将近三分之一,可见“弯道超车”的药品,也不容小觑!
2.4 20个品规通过企业≥3家,5省已暂停部分未通过品种采购资格
就目前来看,通过一致性评价的185个品规中,共有20个品规通过的企业数≥3家。其中,有两个品规目前通过企业数已经达到了8家,分别为苯磺酸氨氯地平片*5mg和富马酸替诺福韦二吡呋酯片*300mg。
值得注意的是,目前同品规通过企业数为2家的有28个,这28个品规将很快集满3家。目前大部分省份明确提出“通过3家以上,不再采购未通过品种”,而广西、江苏、湖北等5省已暂停部分未通过品种的采购资格,意味这些药品已失去这些地区的公立医院市场,可见为了不影响品种销售情况,企业必须加紧通过评价,然后申请重新挂网!
表2:通过企业≥3家的品规一览表(含视同)

注:统计截止日期为2019年5月21日
仿制药一致性评价政策自推行以来,国家及地方积极落实相关政策,企业积极布局,争先通过评价,加上国家带量采购的加持,通过一致性评价不仅是对企业品种质量的要求,也或将是进入集采市场的敲门砖。
今后,通过一致性评价或将成为硬性要求,随着通过评价品种数量增多,未通过评价的品种淘汰的风险将加大。
附:2019年5月一致性评价申报受理品种
Copyright @ HTH官方网站(中国)HTH有限公司 赣ICP备19004952号-1 本站不对转载自互联网的内容负责 如果侵犯了您的权益 请联系我们
赣公网安备 36092302000132号 互联网药品信息服务资格证书编号-非经营性-赣A202007950026
网站建设:中企动力 南昌 SEO标签


